
華東醫藥股份有限公司
-
中美華東醫藥品牌宣傳年度服務
策劃創意,原創插畫,海報設計,藥品包裝設計、折頁設計

中生復諾健生物科技(上海)有限公司
-
中國生物疫苗包裝設計
產品包裝設計,材質工藝建議

浙江金康醫藥有限公司
-
康恩貝制藥年度服,全案賦能,石特大健康與浙江金康醫藥年度合作碩果累累
醫藥品牌全案設計、藥品包裝升級、OTC產品手冊設計、中醫藥產品策劃、產品線形象整合、康恩貝集團合作案例、醫藥營銷物料設計、品牌視覺煥新

太極集團四川綿陽制藥有限公司
-
老藥新裝,價值重塑:石特大健康助力太極綿陽制藥產品矩陣全面升級
醫藥包裝設計,中成藥品牌升級,OTC產品手冊設計,藥品禮盒設計,太極集團包裝設計,品牌全案設計

江蘇申命醫療科技有限公司
-
醫療器械全新產品策劃設計
包裝策劃,結構設計,包裝設計,材質工藝建議,打樣成品制作

人福普克藥業(武漢)有限公司
-
人福普克藥業出口系列包裝設計
系列規劃,系列產品設計,印刷制作工藝建議

浙江華海藥業股份有限公司
-
華海藥業全系列包裝設計升級規范
品牌定位,產品規劃,包裝設計

浙江上藥九洲生物制藥有限公司
-
上海醫藥單品包裝設計,仿制藥一致性評價
產品包裝設計,復雜說明書設計,材質工藝建議

浙江九洲生物醫藥有限公司
-
九洲藥業包裝系列化打造設計
系列策劃,包裝設計,宣傳設計

江蘇福囍醫藥科技有限公司
-
品牌資產變現:福囍醫藥多品類產品包裝的體系化落地設計
品牌包裝落地, 藥品系列化包裝, OTC產品包裝, 保健品包裝設計, 品牌視覺應用, 葫蘆符號設計, 醫藥品牌全案設計公司
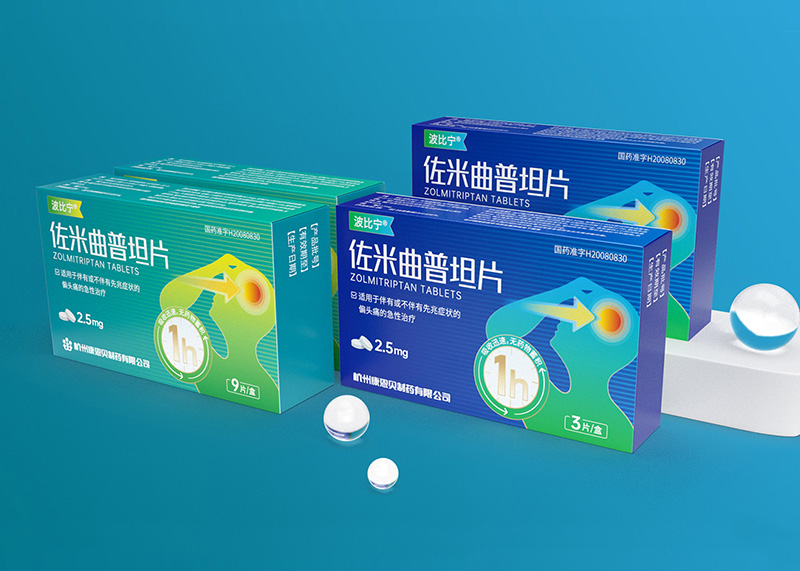
浙江金康醫藥有限公司
-
佐米曲普坦片藥品包裝升級設計
佐米曲普坦片藥品包裝設計

包頭東寶生物技術股份有限公司
-
東寶生物子品牌產品牛骨膠原肽粉包裝設計
品牌定位,產品規劃,包裝設計
藥品委托生產監督管理規定
第一條 為規范藥品委托生產,確保藥品質量安全,根據《中華人民共和國藥品管理法》( 以下簡稱《藥品管理法》)、《中華人民共和國藥品管理法實施條例》,制定本規定。
第二條 境內藥品生產企業之間委托生產藥品的申請、審查、許可和監督管理,適用本規定。
第三條 本規定所稱藥品委托生產,是指藥品生產企業( 以下稱委托方)在因技術改造暫不具備生產條件和能力或產能不足暫不能保障市場供應的情況下,將其持有藥品批準文號的藥品委托其他藥品生產企業( 以下稱受托方)全部生產的行為,不包括部分工序的委托加工行為。
第四條 國家食品藥品監督管理總局負責對全國藥品委托生產審批和監督管理進行指導和監督檢查。各省、自治區、直轄市食品藥品監督管理局負責藥品委托生產的審批和監督管理。
第五條 委托方和受托方均應是持有與委托生產藥品相適應的《藥品生產質量管理規范》認證證書的藥品生產企業。
第六條 委托方應當取得委托生產藥品的批準文號。
第七條 委托生產藥品的雙方應當簽訂書面合同, 內容應當包括質量協議,明確雙方的權利與義務,并具體規定雙方在藥品委托生產管理、質量控制等方面的質量責任及相關的技術事項,且應當符合國家有關藥品管理的法律法規。
第八條 委托方負責委托生產藥品的質量。委托方應當對受托方的生產條件、技術水平和質量管理情況進行詳細考查,向受托方提供委托生產藥品的技術和質量文件,確認受托方具有受托生產的條件和能力。委托生產期間,委托方應當對委托生產的全過程進行指導和監督,負責委托生產藥品的批準放行。
第九條 受托方應當嚴格執行質量協議,有效控制生產過程,確保委托生產藥品及其生產符合注冊和《藥品生產質量管理規范》的要求。委托生產藥品的質量標準應當執行國家藥品標準,其藥品名稱、劑型、規格、處方、生產工藝、原料藥來源、直接接觸藥品的包裝材料和容器、包裝規格、標簽、說明書、批準文號等應當與委托方持有的藥品批準證明文件的內容相同。
第十條 委托方和受托方有關藥品委托生產的所有活動應當符合《藥品生產質量管理規范》的相關要求。
第十一條 在委托生產的藥品包裝、標簽和說明書上,應當標明委托方企業名稱和注冊地址、受托方企業名稱和生產地址。
第十二條 麻醉藥品、精神藥品、藥品類易制毒化學品及其復方制劑,醫療用毒性藥品,生物制品,多組分生化藥品,中藥注射劑和原料藥不得委托生產。國家食品藥品監督管理總局可以根據監督管理工作需要調整不得委托生產的藥品。
放射性藥品的委托生產按照有關法律法規規定辦理。
第十三條 申請藥品委托生產,由委托方向所在地省、自治區、直轄市食品藥品監督管理局提出申請。委托方應當填寫《藥品委托生產申請表》(見附1),并按照本規定要求提交申請材料(見附2)。
第十四條 對于委托方和受托方不在同一省、自治區、直轄市的,委托方應當首先將《藥品委托生產申請表》連同申請材料報受托方所在地省、自治區、直轄市食品藥品監督管理局審查;經審查同意后,方可按照本規定第十三條的規定申報。
受托方所在地省、自治區、直轄市食品藥品監督管理局對藥品委托生產的申報資料進行審查,并結合日常監管情況出具審查意見。審查工作時限為20 個工作日。
第十五條 委托方所在地省、自治區、直轄市食品藥品監督管理局接到藥品委托生產申請后,應當在5 個工作日內作出受理或者不予受理的決定,出具書面的《受理通知書》或者《不予受理通知書》,并注明日期。
第十六條 委托方所在地省、自治區、直轄市食品藥品監督管理局組織對藥品委托生產的申報資料進行審查。對于首次申請,應當組織對受托生產現場進行檢查;對于延續申請,必要時,也可以組織檢查。生產現場檢查的重點是考核受托方的生產條件、技術水平和質量管理情況以及受托生產的藥品處方、生產工藝、質量標準與委托方的一致性。
對于委托方和受托方不在同一省、自治區、直轄市的,生產現場檢查由委托方所在地省、自治區、直轄市食品藥品監督管理局聯合受托方所在地省、自治區、直轄市食品藥品監督管理局組織開展。檢查組成員應當包括委托生產雙方所在地省、自治區、直轄市食品藥品監督管理局派出的檢查人員,檢查報告應當由檢查組全體人員簽名,并報送委托生產雙方所在地省、自治區、直轄市食品藥品監督管理局。
第十七條 委托方所在地省、自治區、直轄市食品藥品監督管理局應當自受理之日起20 個工作日內,按照本規定的條件對藥品委托生產的申請進行審查,并作出決定;20 個工作日內不能作出決定的,經本部門負責人批準,可以延長10 個工作日,并應當將延長期限的理由告知委托方。需要進行生產現場檢查的,所需時間另計。生產現場檢查時限由各省、自治區、直轄市食品藥品監督管理局確定,最長不得超過40 個工作日。需企業補正材料的,現場檢查發現缺陷內容要求企業整改的,對整改情況需進行現場核查的,所需時間不計算在上述期限內。
經審查符合規定的,應當予以批準,并自書面批準決定作出之日起10 個工作日內向委托方發放《藥品委托生產批件》( 見附3);不符合規定的,書面通知委托方并說明理由。
第十八條 《藥品委托生產批件》有效期不得超過3 年。
委托生產雙方的《藥品生產許可證》、《藥品生產質量管理規范》認證證書或委托生產藥品批準證明文件有效期屆滿未延續的,《藥品委托生產批件》自行廢止。
第十九條 《藥品委托生產批件》有效期屆滿需要繼續委托生產的,委托方應當在有效期屆滿3 個月前,按照本規定第十三條、第十四條的規定申報,辦理延續手續。
第二十條 委托方、受托方和委托生產藥品中任一項發生實質性變化的,按照首次申請辦理審批手續;同一受托方,受托生產地址不變但生產線發生變化的,按照延續申請辦理審批手續,但須同時提交補充材料(見附2)。
第二十一條 《藥品委托生產批件》載明的內容應當與委托生產雙方的《藥品生產許可證》、《藥品生產質量管理規范》認證證書及委托生產藥品批準證明文件載明的相關內容一致。
第二十二條 委托方和受托方企業名稱、地址名稱等變更但未發生實質性變化的,應當在發生變更之日起1 個月內,向委托方所在地省、自治區、直轄市食品藥品監督管理局提交申請材料(見附2),辦理變更手續。委托方所在地省、自治區、直轄市食品藥品監督管理局應當在15 個工作日內辦理相應變更手續,在原《藥品委托生產批件》備注欄注明變更的內容和時間,并按照變更后的內容重新核發《藥品委托生產批件》。變更后的《藥品委托生產批件》有效期不變。
第二十三條 委托生產合同提前終止的,委托方應當及時向所在地省、自治區、直轄市食品藥品監督管理局提交終止委托生產的申請,辦理注銷手續。
按照本規定第十八條的規定予以廢止的和未按照本規定第十九條的規定辦理延續手續的,委托方所在地省、自治區、直轄市食品藥品監督管理局依法注銷《藥品委托生產批件》。
第二十四條 各省、自治區、直轄市食品藥品監督管理局應當制定藥品委托生產審批工作程序和要求,完善審批管理系統,規范審批工作。
第二十五條 各省、自治區、直轄市食品藥品監督管理局應當在行政機關的網站和辦公場所公示申請藥品委托生產所需要的條件、程序、期限、需要提交的全部材料的目錄和申請書示范文本等。
各省、自治區、直轄市食品藥品監督管理局應當向申請人提供可查詢的藥品委托生產受理、審批的進度和結論等信息。
第二十六條 委托方和受托方不在同一省、自治區、直轄市的,委托方所在地省、自治區、直轄市食品藥品監督管理局應當及時將委托生產申請的批準、變更和注銷情況告知受托方所在地省、自治區、直轄市食品藥品監督管理局。
第二十七條 各省、自治區、直轄市食品藥品監督管理局應當組織對本行政區域內委托生產藥品的企業(包括委托方和受托方)進行監督檢查。
對于委托方和受托方不在同一省、自治區、直轄市的,委托方所在地省、自治區、直轄市食品藥品監督管理局可以聯合受托方所在地省、自治區、直轄市食品藥品監督管理局組織對受托方受托生產情況進行延伸檢查。
監督檢查和延伸檢查發現企業存在違法違規行為的,依法予以處理。
第二十八條 提供虛假材料,或者采取欺騙、賄賂等不正當手段取得《藥品委托生產批件》的,應當予以撤銷,三年內不受理該申請人提出的該藥品委托生產申請;涉及違法行為的,依法予以處理。
第二十九條 委托方未按照本規定要求履行生產監督和質量管理責任的,依照《藥品管理法》第七十九條的規定, 給予警告, 責令限期改正;逾期不改正的,責令其停止委托生產,《藥品委托生產批件》到期后不予延續;情節嚴重、吊銷《藥品生產許可證》的,還應當注銷《藥品委托生產批件》。
第三十條 受托方未按照《藥品生產質量管理規范》組織藥品生產的,依照《藥品管理法》第七十九條的規定予以處罰。
第三十一條 擅自委托或者接受委托生產藥品的,對委托方和受托方均依照《藥品管理法》第七十四條的規定予以處罰。
第三十二條 委托生產雙方所在地省、自治區、直轄市食品藥品監督管理局應當及時通報監督檢查情況和處理結果。重大問題,應當及時上報國家食品藥品監督管理總局。
第三十三條 各省、自治區、直轄市食品藥品監督管理局應當定期對委托生產審批和監管情況進行匯總、分析和總結,并在每年3 月31 日前將上一年度情況報國家食品藥品監督管理總局。
第三十四條 本規定自2014 年10 月1 日起實施。此前有關藥品委托生產要求與本規定不一致的,以本規定為準。本規定所列附件是規定的組成部分,與本規定具有同等效力。

 0571-88685587
0571-88685587 15605889708
15605889708